侯晨鹞 河南省汝阳县第一高级中学 邮编471200
联系电话:0379-68262515电子信箱:hcy278589@sohu.com
★盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。即:
如:已知下列三个热化学方程式
①H
2(g)+
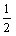 O2
O2(g)====H
2O(g);Δ
H=-241.8 kJ·mol
-1②C(s)+O2(g)====CO2(g);ΔH=-393.5 kJ·mol-1
③C(s)+H2O(g)====CO(g)+H2(g);ΔH=+131 kJ·mol-1
写出碳燃烧生成CO和CO燃烧的热化学方程式。应用盖斯定律,对几个化学方程式变换和叠加,可以得出要写的化学方程式,对应的反应热的数值、符号也随之相应地成比例的变化。所以由①+③可得:C(s)+
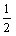 O2
O2(g)====CO(g);Δ
H=-110.8 kJ·mol
-1……④。同样由②-④可得:CO(g)+
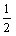 O2
O2(g)====CO
2(g);Δ
H=-282.7 kJ·mol
-1。
★典例剖析
例1(2007年重庆卷13).已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ C. 436 kJ D.188 kJ
答案:C
解析:本题考查了反应热(焓变的计算方法)。
2H2(g)+O2(g)===2H2O(g) ΔH
2 mol ΔH
0.5 mol -121 kJ
ΔH=-484 kJ·mol-1
设1 mol H—H断裂时的反应热为ΔH‘,则根据盖斯定律可得:
ΔH=2ΔH‘+496 kJ+(-4×463 kJ)=-4×121kJ,故ΔH‘=+436 kJ。
从而可知:1mol H-H键断裂时吸收热量为:436 kJ
例2(2007年海南卷新课标6).已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH=-348.3kJ/mol
(2) 2Ag(s)+1/2 O2(g)== Ag2O(s),ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于
A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.317.3 kJ/mol
答案:A
解析:本题考查反应热的计算。由盖斯定律,两式相减整理得:Zn(s)+Ag2O(s)===ZnO(s)+2Ag ; ΔH=-317.3 kJ·mol-1
★实战演练
1.已知3.6 g 碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ·mol-1,则1 mol C与O2反应生成CO的反应热ΔH为( )
A.-Y kJ·mol-1 B.-(10X-Y) kJ·mol-1 C.-(5X-0.5Y) kJ·mol-1 D.+(10X-Y) kJ·mol-1
2.科学家发现,不管化学反应是一步完成或分几步完成,该反应的热效应是相同的。已知在25 ℃,105 Pa时,1 mol C(石墨)完全燃烧生成CO2气体,放热393.5 kJ,1 mol CO完全燃烧生成CO2气体放热283.0kJ,下列说法正确的是( )
A.在25 ℃,105Pa时,C(石墨)燃烧生成CO气体的热化学方程式是:
2C(石墨)+O2(气)==2CO(气);ΔH=110.5 kJ·mol-1
B.C(石墨)不完全燃烧,生成CO2和CO混合气体时,放热283.0 kJ
C.C(石墨)和CO2(气)反应生成CO(气)的反应是放热反应
D.如果金刚石燃烧生成CO2的反应热大于石墨燃烧生成CO2的反应热,则可以断定从石墨转变为金刚石需要吸热
★参考答案:
1.答案:C
解析:由3.6 g C与6.4 g O2完全反应,可知生成CO2与CO之比为1∶2。设36 g C按此方式反应,则生成1 mol CO2和2 mol CO,C单质燃烧热为Y kJ·mol-1,1 mol C与O2生成CO的反应热为:
-1/2(10X-Y)kJ·mol-1,即-(5X-0.5Y)kJ·mol-1,C正确。
2.答案:D
解析:1 mol石墨完全燃烧所放出的热量大于1 mol CO完全燃烧放出的热量,所以石墨转化成CO是放热反应。A错。C项石墨与二氧化碳反应是吸热反应。